Resumo USCAP 2025: Annual Meeting: Companion Society Bundle
- SNOLA

- 29 de jul. de 2025
- 6 min de leitura
Curso patrocinado pela American Association of Neuropathologists (18 de Abril de 2025).
Este curso é destinado a patologistas gerais e neuropatologistas atuantes e fornece uma atualização sobre questões clínicas recorrentes em uma era de novos dados sobre etiologias moleculares e uma necessidade crescente de fornecer cuidados de maneira consciente em termos de recursos.
Comentários realizados pelo dr. Igor Fernandes, patologista em Laboratório Bacchi, São Paulo, e membro coordenador do comitê de neuropatologia da SNOLA (igor@labbacchi.com.br).
Parte 1 — Resumo baseado na apresentação "Diagnostic approach to CNS embryonal tumors: Medulloblastoma and beyond", apresentada por Jennifer Cotter, MD (Children’s Hospital Los Angeles), com integração de dados complementares do Highlights ASCO 2025.
Conceito e Evolução Histórica
Tumores embrionários do SNC (CNS ETs) são tumores malignos de células pequenas e redondas, geralmente com diferenciação neuroectodérmica mínima. A terminologia "PNET" foi abandonada com o avanço da classificação molecular, que passou a definir entidades tumorais com base em assinaturas genéticas e epigenéticas específicas. Atualmente, tumores primários de CNS são a causa mais comum de morte em pacientes com câncer entre 0–14 anos.
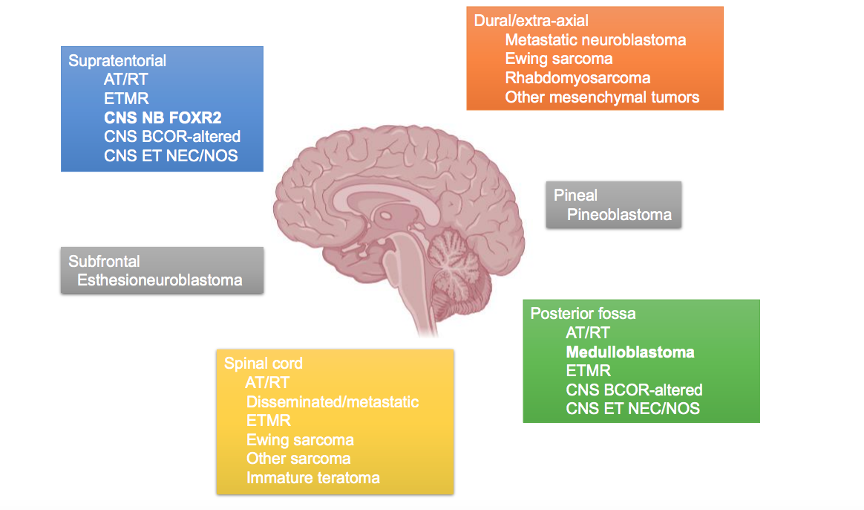


Classificação Atual e Tumores Canônicos
1. ATRT (Atypical Teratoid/Rhabdoid Tumor)
- Localização variada no SNC, predominância em crianças <5 anos.
- Associado à deleção bialélica de SMARCB1 (ou SMARCA4).
- Subgrupos moleculares: TYR, SHH, MYC.
- Diagnóstico com imuno-histoquímica: perda de INI1.
- Até 1/3 dos casos com mutação germinativa associada à síndrome de predisposição rabdoide.

Comentário: a subclassificação molecular em ATRT ainda não é exigência por critérios da WHO (fatores preditivos em relação aos subgrupos ainda em estudo). Os raros casos de tumores selares, que parecem ser uma entidade distinta, mais comum em mulheres adultas de meia idade, frequentemente se encaixam no grupo MYC. Estudos recentes demonstram, ainda, diferenças fenotípicas nos subgrupos pediátricos (doi: 10.1111/bpa.12967).
2. Meduloblastoma
- Tumor maligno mais comum da fossa posterior na infância.
- Classificação molecular: WNT-ativado, SHH-ativado (TP53 wildtype/mutado), Grupos 3 e 4.
- Subtipos histológicos: clássico, desmoplásico/nodular, MBEN, anaplásico.


Comentário: A imuno-histoquímica apresenta-se como surrogate para uma classificação inicial desse tumor. A inclusão do OTX2 no painel (não presente na aula - doi: 10.1097/PAS.0000000000001640) aumenta a especificidade. Convém ressaltar que os raros meduloblastomas com diferenciação miogênica frequentemente não exibem os padrões consistentes acima descritos de imuno-histoquímica. A classificação idealmente é complementada com perfil de metilação ou análise de perfil de expressão gênica/transcripcional.


3. Tumor Embrionário com Rosetas em Multicamada (Embryonal Tumor with Multilayered Rosettes - ETMR)
- Tipicamente <4 anos; associado a alteração do locus C19MC.
- Subtipos anteriores (meduloepitelioma, ependimoblastoma) reunidos.
- LIN28A fortemente positivo em IHC; subgrupo com mutações em DICER1 alternativamente. Os ETMRs com mutação DICER1 atuam como um substituto molecular para os ETMRs alterados por C19MC porque ambos os eventos genéticos interrompem a homeostase do miRNA, levando a um programa oncogênico convergente caracterizado por características de células-tronco, inibição de diferenciação e instabilidade genômica.

Tumores Embrionários Raros ou Emergentes
4. CNS Neuroblastoma, FOXR2-ativado
- Tumor supratentorial, bem delimitado, OLIG2 e TTF1 positivos.
- Rearranjos complexos de FOXR2, ganho de 1q e perda de 16q.
Comentário: Estudo recente demonstra que esses tumores, além da peculiaridade da positividade de Sinapto + OLIG2 + TTF1, também exibem positividade para SOX10 e padrão de ganho do 1q (podendo ser visualizado por FISH) com relativa especificidade (ver referência abaixo). Acredito ser importante como work-up inicial, porque as alterações do FOXR2 são de difícil caracterização por métodos moleculares complementares usuais, sendo o mais prático o uso de métodos convencionais básicos (ver referência abaixo) com a análise posterior por perfil de metilação.

Comentário: a imuno-histoquímica por BCOR, apesar de positiva nos casos com ITD, mais comuns em crianças, não é inteiramente específica, podendo ser positiva em astroblastomas, MN1-alterados. Casos com fusão EP300::BCOR não exibem positividade consistente para esse marcador e frequentemente não exibem o aspecto embrionário usual dos ITDs, tendo fenótipo glial/ependimário (doi: 10.1007/s00401-022-02508-2).
6. CNS ET NEC/NOS (Entidades emergentes)
- Tumores que não se enquadram nas classificações atuais.
- Identificação por exclusão e perfil de metilação.
- Novas fusões e amplificações descritas aumentam o leque de diferenciais desses tumores.
Ex 1: Tumor Embrionário do SNC com amplificação de PLAGL2 (IHC: GFAP) (fonte: laboratório Bacchi)

Ex 2: Tumor do SNC com fusão PATZ1. Note a cromotripsia do cromossomo 22 (IHC: GFAP) (fonte: laboratório Bacchi).

Diagnóstico Integrado
- IHC para triagem inicial: INI1, LIN28A, OLIG2, β-catenina etc.
- NGS para mutações importantes (SMARCB1, SUFU, TP53, DICER1).
- Perfil de metilação: importante na atribuição a subgrupos conhecidos ou novos.
Referências Principais

Parte 2 — Update em Tumores Espinhais. Resumo baseado na apresentação do USCAP 114th Annual Meeting (SEE THE LIGHT) por PJ Cimino, do National Institutes of Health (NIH).
1. Abordagem Intraoperatória: O Diagnóstico Começa no Ato Cirúrgico
O manejo diagnóstico de tumores da medula espinhal se inicia no intraoperatório, exigindo preparo prévio do patologista com base em:
- História clínica: idade, antecedentes de neoplasias, história familiar.
- Aspectos radiográficos (essencialmente RM):
• Focal vs disseminado
• Realce com contraste
• Localização segmentar (cervical, torácico, lombossacral, cauda equina)
• Presença de componente intracraniano
- Localização intradural:
• Extramedular: neoplasias meníngeas ou neurais
• Intramedular: neoplasias gliais ou glioneuronais
2. Diagnóstico Topográfico: Parênquima e Envolvimento Intradural
A topografia define o tipo provável de neoplasia:
- Intradural, Extramedular:
• Tumores de nervo paraespinhal (schwannoma, neurofibroma, MPNST)
• Tumores meníngeos (meningioma, hemangioblastoma)
• Gliomas exofíticos
- Intradural, Intramedular:
• Ependimomas (inclusive variantes como mixopapilar)
• Astrocitomas (baixo e alto grau)
• Tumores glioneuronais e gliomas difusos infiltrativos (IDH selvagem ou mutado)
3. Diagnóstico Diferencial Neoplásico em Medula Espinhal
Gliais/Ependimários:
- Ependimomas: clássico, mixopapilar (MYCN amplificado), subependimoma
- Gliomas difusos IDH selvagem: GBM, astrocitoma, oligodendroglioma
- Astrocitoma circunscrito: pilocítico, pilomixoide, astroblastoma MN1-alterado
- Tumores glioneuronais: ganglioglioma, DLGNT
Não-gliais:
- Tumores de nervo paraspinal: schwannoma, neurofibroma, MPNST
- Mesenquimais: meningioma, hemangioblastoma
- Melanocíticos primários: melanocitoma, melanoma, melanocitose
4. Condutas Intraoperatórias: Manuseio do Material
- Evitar congelar todo o tecido.
- Esfregaços citológicos (touch/smear):
• Úteis em pequenos fragmentos.
• Preservam detalhes nucleares (atipias, mitoses, inclusões).
• Avaliam processos celulares (gliais, meningoteliais).
- Congelação:
• Exige mais tecido. Não incluir o tecido inteiro.
• Permite análise arquitetural (difuso vs circunscrito).
• Informa padrão de celularidade e necrose/vascularização.
5. Condutas Intraoperatórias: Manuseio do Material
• Algarismos arábicos em vez de romanos para o grau.
• Grau a depender primeiramente do tipo histológico, com o modificador "anaplásico" removido
• Classificação histológica e molecular combinada para certos tumores
• Classificação do ependimoma: localização anatômica, histopatologia e características moleculares ou seja, ependimoma espinhal, SNC grau 3 da OMS (substitui ependimoma anaplásico, grau III da OMS).
• Designações Não Especificado (NOS) e Não Classificado em Outra Parte (NEC): por exemplo, ependimoma espinhal com classe de metilação correspondente ao grupo A da fossa posterior (PFA), NEC.
6. Tumores Espinhais Específicos: Destaques
6.1. Ependimoma Espinhal, com amplificação MYCN.
- Ependimomas exibem perfil genético/epigenético distinto em diferentes sítios.
- O subgrupo com amplificação MYCN (mais agressivo) agrupa de forma distinta em perfil de metilação.


6.2. Glioma Difuso da Linha Média, H3 K27-Alterado.
- Glioma infiltrativo com perda do H3 K27me3 e usualmente substituição H3 c.83A>T p K27M em uma das isoformas da histona H3, expressão aberrante de EZHIP ou mutação de EGFR.
- Grau 4 (WHO).
Comentário: importante destacar que um subset desses tumores com mutação H3 K27M pode exibir aspecto circunscrito e alterações da MAPK, com possível potencial prognóstico/preditivo distinto (doi: 10.1007/s00401-023-02640-7).
6.3. Astroblastoma, MN1-alterado:
- Tumor glial circunscrito, com alteração MN1.
- Células arredondadas/cuboidais com pseudorrosetas perivasculares e hialinização.
- Critérios essenciais:
• Padrão astrobástico
• Alteração MN1
• (se necessário) perfil de metilação compatível
- Desejável: GFAP e EMA positivos
Fusões Emergentes: BEND2:
- BEND2 pode ser mais relevante que MN1 (analogia com RELA/ZFTA em ependimomas supratentoriais).
- Fusões descritas:
• MN1::BEND2
• EWSR1::BEND2 (já observado em tumores medulares)
Subtipo molecular epigenético distinto, com dados apresentados em Acta Neuropathologica (2022) (doi: 10.1007/s00401-021-02388-y)

Comentário: alguns casos não exibem padrão morfológico clássico, com pseudorosetas, ou marcação para GFAP/OLIG2. Podem ser epitelioides e marcar, ainda, para citoceratinas à imuno-histoquímica. Vide o caso abaixo (fonte: laboratório Bacchi).


6.4. Tumor Neuroendócrino da Cauda Equina.
- Antigo “Paraganglioma da Cauda Equina”.
- Surge da crista neural especializada da cauda equina/filum terminale.

Comentário: Os tumores neuroendócrinos da cauda equina são histogeneticamente e molecularmente distintos dos paragangliomas e feocromocitomas de fora do SNC. Eles superexpressam o fator de transcrição HOXB13, que é expresso no desenvolvimento na extensão caudal da medula espinhal e no seio urogenital, uma característica que compartilham com ependimoma mixopapilar. Até o presente momento, esses tumores não foram observados em pacientes com síndrome de paraganglioma/feocromocitoma hereditário devido a mutações nos genes da subunidade da succinato desidrogenase (SDHx). A grande maioria dos tumores neuroendócrinos da cauda equina é de crescimento lento e curável por excisão total; apenas 4% recidivam após a remoção total.
.png)

Comentários